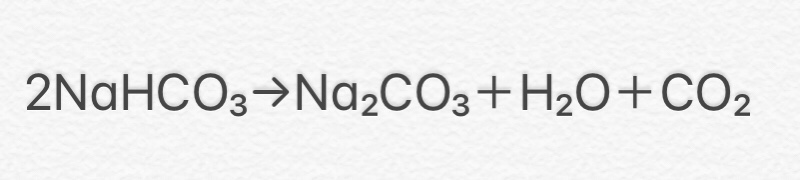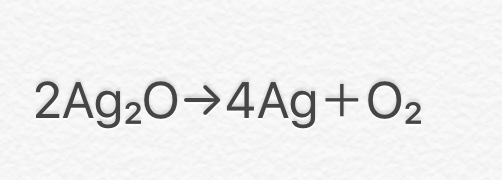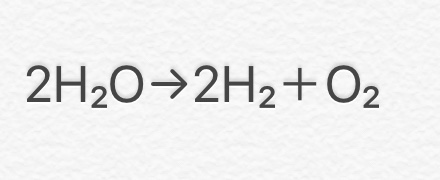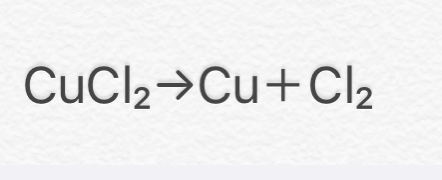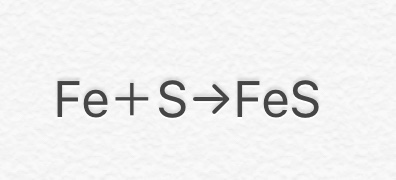こんにちは!個別指導塾の現役塾長です。
今回は中学2年で学習する化学分野の、「化学反応」についてクイズを出題します。
クイズの後には解説やテストに出やすいポイントまとめがありますので、参考にしてください!
それではいってみましょう!
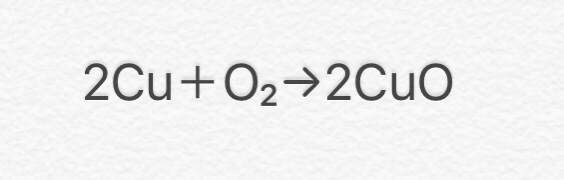
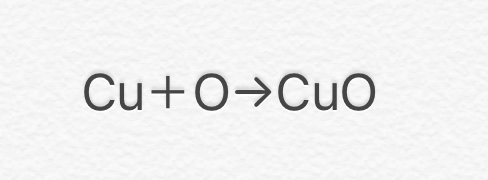
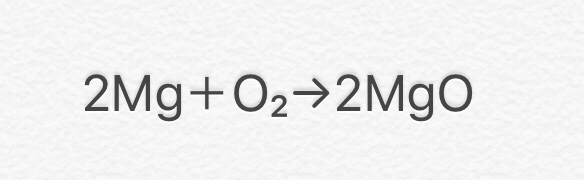
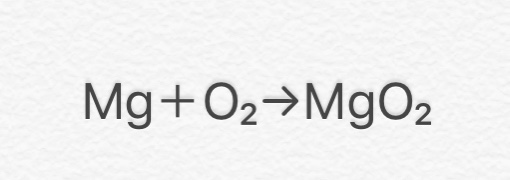
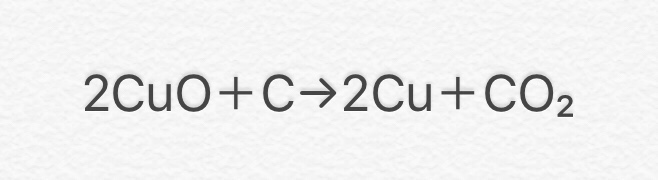
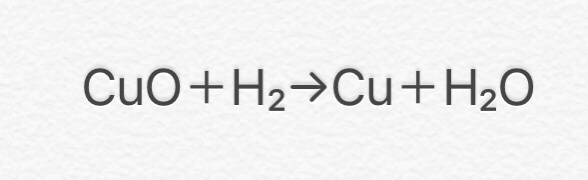
解説・ポイントまとめ
【炭酸水素ナトリウム(白)の加熱分解】
・炭酸ナトリウム(白)、水、二酸化炭素が生じる
・水の検出には塩化コバルト紙を使う(水にふれると青から赤に変化)
・二酸化炭素の検出には石灰水を使う
・炭酸水素ナトリウムと炭酸ナトリウムの違い
| 加熱前 | 加熱後 | |
|---|---|---|
| 名称 | 炭酸水素ナトリウム | 炭酸ナトリウム |
| 水への溶けやすさ | 溶けにくい | 溶けやすい |
| フェノールフタレイン溶液の反応 | うすい赤 (弱アルカリ性) | 濃い赤 (アルカリ性) |
☝この実験はとてもよく出てきます。上のポイントも大事ですが、更に実験の注意点もよく聞かれます。2つの注意点を覚えておきましょう。
①火を止める前に管を抜く(逆流して試験管が割れるのを防ぐため)
②試験管の入り口を下げる(発生した水により試験管が割れるのを防ぐため)
【酸化銀(黒)の加熱分解】
・酸素と銀(白)が生じる
・発生した気体が酸素であることを確かめるために火のついた線香を入れる
☝銀が白色っていうと「えっ?銀色じゃないの?」って思う人もいますが、分解したばかりの状態では白い粉末に見えます。こすると金属光沢が出て銀らしくなります。
【水の電気分解】
・陽極に酸素、陰極に水素が発生
・発生する気体の体積比は水素:酸素=2:1
・少量の水酸化ナトリウムを混ぜる
☝「マイナ水素のプラ酸素!」と覚えましょう。
上の化学反応式の係数からも水素:酸素=2:1とわかるのですが、更に詳しく説明します。
モデル図で書くと、水素原子を●、酸素原子を〇として次のようになります。
●〇● ●〇● → ●● ●● + 〇〇
このモデル図のとおり、水素分子が2つ、酸素分子が1つ出てくるので、2:1の体積比になります。
また、純粋な水は電流がほとんど流れないため、流れやすくするために水酸化ナトリウム(NaOH)を混ぜます。
【塩化銅の電気分解】
・陽極に塩素、陰極に銅が出てくる
・電流を流し続けると、水溶液の青色が薄くなる
☝青色が薄くなる理由は中3で学びますが、簡単に言うと銅イオン(青色)っていうやつが銅(赤褐色)に変化していくためです。
☝塩素の性質
・水に溶けやすい
・刺激臭
・漂白作用
・黄緑色
【鉄と硫黄の化合】
・強い反応熱により自然に反応が進むので、反応し始めたら加熱をやめる
・反応前後の違い
反応前 反応後
名前 鉄・硫黄(混合物) 硫化鉄
磁石 くっつく くっつかない
塩酸との反応 水素が発生 硫化水素が発生
☝水素は無臭ですが、硫化水素は腐卵臭と言って特有のにおいがあります。加熱の前後で異なる気体が発生するので、別の物質に変わったと言えるのです。
【中2で学習する重要な化学反応式10個】
<分解>
① 2NaHCO3 → Na2CO3 + H2O + CO2
(炭酸水素ナトリウム→炭酸ナトリウム+水+二酸化炭素)
② 2Ag2O → 4Ag + O2
(酸化銀→銀+酸素)
③ 2H2O → 2H2 + O2
(水→水素+酸素)
④ CuCl2 → Cu + Cl2
(塩化銅→銅+塩素)
<化合>
⑤ Fe + S → FeS
(鉄+硫黄→硫化鉄)
<酸化>
⑥ C + O2 → CO2
(炭素+酸素→二酸化炭素)
⑦ 2Cu + O2 → 2CuO
(銅+酸素→酸化銅)
⑧ 2Mg + O2 → 2MgO
(マグネシウム+酸素→酸化マグネシウム)
<還元>
⑨ 2CuO + C → 2Cu + CO2
(酸化銅+炭素→銅+二酸化炭素)
⑩ CuO + H2 → Cu + H2O
(酸化銅+水素→銅+水)
☝「酸化」は「化合」でもありますが、酸素との化合を特に「酸化」と言います。
☝「酸化」と「還元」は同時におこるので本当は分けなくてもいいんですが、テストだと「銅の酸化の反応式を書け」とか「酸化銅の還元の反応式を書け」と出題されますので、上のように書きました。
クイズ・解説は以上です!