こんにちは!個別指導塾の現役塾長です。
このページでは、「電池や酸・アルカリ」に関するクイズを出題しています。
下のほうに解説もありますので、参考にしてください!
それではいってみましょう!
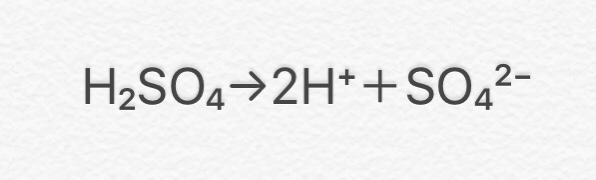
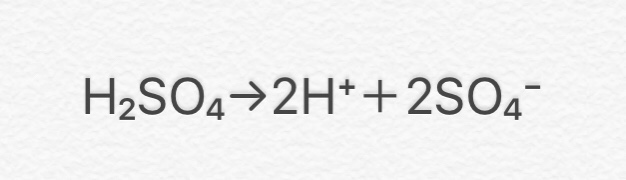
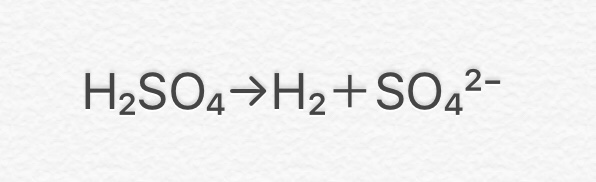
解説
【イオン化傾向の覚え方】
Na>Mg>Al>Zn>Fe>Cu
「なあマジある?会えん鉄道」
なあ(Na)マジ(Mg)ある(Al)
会えん(Zn)鉄(Fe)道(Cu)
※高校だともっと細かくやります。参考に載せておきます。
K>Ca>Na>Mg>Al>Zn>Fe>Ni>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au
「貸そうかな、まあ当てにすんなひどすぎる借金」
貸そう(K)か(Ca)な(Na)ま(Mg)あ(Al)あ(Zn)て(Fe)に(Ni)すん(Sn)な(Pb)ひ(H)ど(Cu)す(Hg)ぎる(Ag)借(Pt)金(Au)
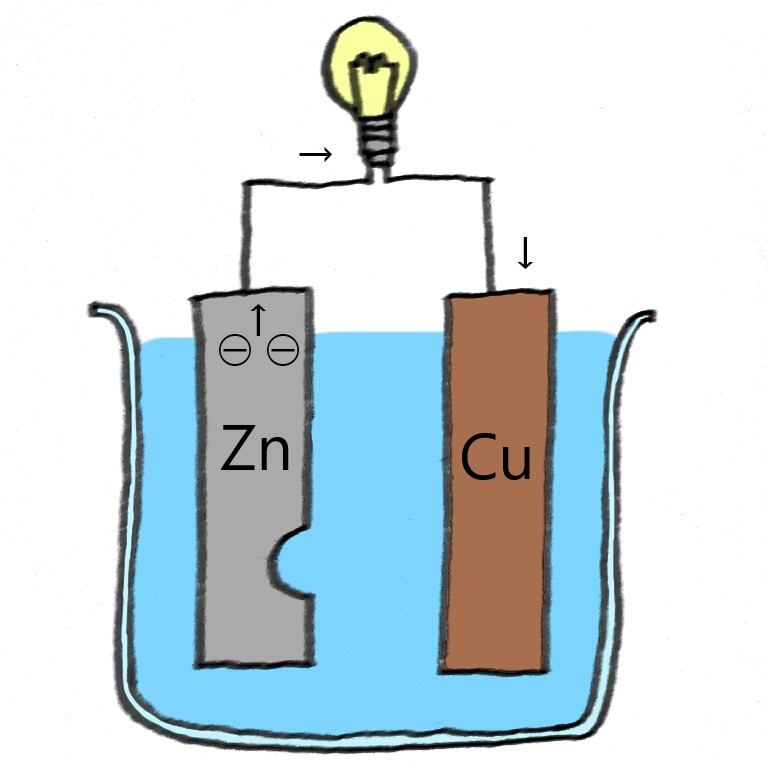
【電池の仕組み】
亜鉛板と銅板と塩酸で電池を作った場合
①イオン化傾向の大きいほうの金属が電子(⊖)を失いイオンになり溶ける
(上の図だとZnが2つ電子を失い、Zn2+になり水溶液中に出ていく)
Zn → Zn2+ + ⊖⊖
②①で失われた電子が導線を通って電球まで行くと電球が光る
③その後電子が銅板まで行き、水溶液中にいた2個の水素イオン(H+)が1つずつ電子(⊖)を受け取り、水素分子(H2)となって発生
2H+ + ⊖⊖ → H2
☝電圧を大きくするには、イオン化傾向の差が大きくなるような組み合わせで2種類の金属を選べばOK!(ナトリウムは反応性が大きすぎて空気中でも変化してしまうので、この実験には使いません。)
【電池ができる条件】
・2種類の金属板
・電解質水溶液
☝「同じ種類だとダメ」とか、「エタノールだとダメ」などと問題には出てきます。
【電流の向きと電子の流れる向きは逆】
上の図で、
電子は亜鉛板(負極)→銅板(正極)に流れている
電流は銅板(正極)→亜鉛板(負極)に流れている
☝電流は+から-(正極から負極)に流れるが、電子は-から+に流れます。
これは電子が発見される前に昔の人がそう決めちゃったからです。
【燃料電池の仕組み】
水素と酸素が化合するときに生じるエネルギーを、電気エネルギーとして取り出す
2H2 + O2 → 2H2O
【酸・アルカリとは?】
【酸】
水溶液にしたときに電離して水素イオン(H+)を生じる化合物
(例)塩酸(HCl)
硫酸(H2SO4)
硝酸(HNO3)
【アルカリ】
水溶液にしたときに電離して水酸化物イオン(OH–)を生じる化合物
(例)水酸化ナトリウム(NaOH)
水酸化バリウム(Ba(OH)2)、
水酸化カルシウム(Ca(OH)2)
アンモニア(NH3)
【水溶液の液性による試薬の色の変化】
| 酸性 | 中性 | アルカリ性 | |
|---|---|---|---|
| リトマス紙 | 青→赤 | 変化なし | 赤→青 |
| pH試験紙 | 赤 | 緑 | 青 |
| BTB溶液 | 黄色 | 緑 | 青 |
| フェノール フタレイン溶液 | 変化なし | 変化なし | 無色→赤 |
【酸性溶液と金属の反応】
水素が発生する
①金属が電子を失いイオンになる
②その電子をH+が受け取り、H2 分子になって出てくる
酸性溶液には必ずH+がいますね。金属が捨てた⊖をH+がもらうわけです。
これが酸性溶液に金属を入れたときに水素が発生する理由です。
ただし、金とか銀とか白金など、高級そうな金属はイオン化傾向が小さいので、酸性溶液に入れても電子を失いません。すなわち水素は発生しません。
金・白金を溶かそうと思ったら、濃塩酸と濃硝酸を3:1の比で混ぜた王水っていうスペシャルな液体を使わないといけません。
以上です。難しいところですので、少しずつ確実に理解していきましょう!